На макроуровне это воспринимается как повышение давления и температуры. Повышение давления после сжатия часто связывается в первую очередь с ростом числа воздействий на единицу площади стенки сосуда, а рост температуры объясняется ростом кинетической энергии каждого воздействия, поскольку сжимать газ поршень в конце концов остановился и передал свой импульс молекулам газа, несколько увеличив их скорость и кинетическую энергию - то есть тепловая энергия сжатого газа возросла за счет внешней работы, которая понадобилась для его сжатия. Впрочем, при вдумчивом размышлении становится ясно, что причины роста давления и температуры нельзя разделить так однозначно, как об этом только что говорилось - и увеличение частоты ударов при той же энергии каждого удара ведет к повышению температуры и увеличения средней силы ударов при сохранении их количества в единицу времени приводит к некоторому повышению давления, так что рост температуры и давления при адиабатическом сжатии в принципе неразделимы.
По представлениям классической термодинамики, молекулы газа, даже находится в равновесном состоянии, имеют широкий диапазон мгновенных скоростей, различающихся не только по направлению, но и по абсолютной величине. При этом если направления в среднем равномерно распределены по сторонам, то абсолютные величины скоростей частиц лежат в очень широком диапазоне. Большинство частиц имеют скорость, близкую к некоторой усредненной величиной, находится внутри этого диапазона, однако всегда существует определенное количество более быстрых и более медленных частиц. Этот профиль распределения статистически стабильным и соответствует гауссовый распределения вероятностей, а теоретический диапазон возможных скоростей лежит в пределах от 0 до бесконечности.
С точки зрения обычной механики утверждение о наличии при равновесном состоянии газа огромного разброса скоростей его частиц выглядит абсолютно нелогичным. Действительно, при упругом столкновении двух шаров они могут обменяться импульсами частично или почти полностью. Теоретически возможен и совершенно полный обмен импульсами, но это идеальный случай - на практике всегда находится причина, по которой этого не происходит! А в результате многих столкновений с частичным обменом импульсами в среде, состоящей из таких хаотично движущихся шаров одинаковой массы (ведь это и есть механическая модель идеального газа), их скорости постепенно выровняются и будут практически одинаковыми (с учетом частоты столкновений в нормальных атмосферных условиях для этого потребуются лишь малые доли секунды).
И еще одно обстоятельство. С точки зрения ЕМТ тепловая энергия в газах при относительно низких давлениях находится преимущественно в кинетической форме, в твердых телах - почти полностью в потенциальной (в виде колебательных напряжений кристаллической решетки) , а в редких - в значительной степени в потенциальной форме, массово переходя в кинетическую только на границе раздела с неплотными газообразными средами. В связи с этим обсуждаемое ниже относится прежде всего к газам и в меньшей степени - к жидкостям.
Следующий шаг - испаритель, плоская металлическая камера (обычно это внутренняя стенка холодильника). Хладагент попадает в испаритель через очень узкое отверстие и давление резко уменьшается. Жидкость снова становится газом, при этом сильно охлаждается. Когда газ проходит по испарителя, он забирает с него тепло: камера становится холодной, и поэтому холодильник холодит.
При сжатии газ нагревается, количество тепловой энергии у него не меняется, но оно как бы концентрируется в малом объеме, поэтому газ становится горячее. Горячий газ, проходя по конденсатора, отдает свое тепло в окружающее пространство. Именно поэтому конденсатор находится снаружи. За повышенного давления при охлаждении газ превращается в жидкость.
После этого газ снова попадает в компрессор - цикл завершается. Получается, что из-за разницы давления в испарителе и конденсаторе газ забирает тепло из холодильника и выпускает его наружу.
Принципиальным результатом проведенных испытаний является установление возможности без увеличения максимального давления сжатия по сравнению с известными способами достичь рекордной температуры нагрева газа около 10000 С при относительной давления сжатия не выше 500-1000. Подобный режим достигается разделением такта сжатия на две стадии, между которыми производят необратимый пропуск всей массы предварительно нагретого (на первой стадии сжатия) газа через перепускной отверстие и сжатие до конечного давления всей массы газа во второй стадии сжатия. Разделение процесса сжатия на две стадии необратимых пропуском всей массы газа приводит к максимальному увеличению энтропии с падением давления в цилиндре, но с сохранением температуры газа, что позволяет на второй стадии сжатия повысить температуру всей массы газа, повторно сжимая его до максимального давления. Кроме того, при перетекании газа через "короткое " отверстие в дополнительном поршни или в перегородке резко уменьшается время контакта нагретого газа со стенкой отверстия по сравнению с перетеканием газа через длинный канал в прототипе, что приводит к снижению теплопотерь и, следовательно, к увеличению эффективности процесса.
Поршень 1 при своем поступательном движении сжимает газ в пространстве цилиндра 3 до дополнительного поршня 2, предварительно нагревая его до промежуточной температуры, в несколько раз превышает первоначальную. При этом дополнительный поршень играет роль инерционной стенки. В конце первой стадии сжатия (или одновременно со сжатием при постоянном давлении сжатия) вся масса предварительно нагретого газа перетекает в объем цилиндра перед дополнительным поршнем через его отверстие 4. При этом газ тормозится, восстанавливая свою температуру при меньшем давлении, то есть энтропия смеси возрастает. При конце перетекание газа происходит фиксация поршней в вязкую с помощью фиксирующего замка 5. Во второй стадии сжатия при дальнейшем движении связанных поршней нагретый газ досжимается до конечного давления, обеспечивая высокую температуру сжатия.
В варианте 2 при нагревании газа в БУ с перегородкой при перетекании всей массы газа из одной части цилиндра в другую через отверстие с клапаном в перегородке конечная температура при сопоставимых давлениях сжатия в обоих стадиях сжатия достигает величины в 1,5-2 раза больше, чем в варианте 1. Это связано с тем, что в первой стадии нагревается вся масса газа, в то время как в БУ со свободными поршнями при пропуска газа через отверстие в дополнительном поршни в пространство впереди него с последующей фиксацией обоих поршней в вязкую предварительно нагревается только часть газа в пространстве между поршнями.
В варианте 1 решения поставленной задачи достигается предлагаемым способом сверхадиабатического нагрева газа при его сжатии в баллистической установке в две стадии, разделенные стадией пропуска, двумя поршнями - сплошным основным и дополнительным с отверстием для пропуска газа, в котором дополнительный поршень выполнен с возможностью его фиксации в в "связи с основным поршнем, и после первой стадии сжатия и пропуска всей массы газа в пространство впереди дополнительного поршня фиксируют оба поршня в вязкую и проводят вторую стадию сжатия всей массы газа при движении связи поршней до конца цилиндра.
Если сосуд с расширяющимся газом теплоизолировать от окружающей среды, то теплообмен будет отсутствовать, т. е. Q = 0. Процесс, происходящий при соблюдении этого условия, называется адиабатическим.
Уравнение первого начала термодинамики при учете условия Q = 0 прини-мает вид
0 = ΔU + A или A = - ΔU . (109)
Следовательно, при адиабатическом процессе работа совершается только за счет внутренней энергии газа. При адиабатическом расширении газ совершает работу, а его внутренняя энергия и, следовательно, температура падают. При адиабатическом сжатии работа газа отрицательна (внешняя среда производит работу над газом), внутренняя энергия и температура газа возрастают.
Адиабатический процесс можно реализовать практически и при отсутствии хорошей теплоизоляции. Но тогда необходимо вести процесс столь быстро, чтобы за время его осуществления не произошел сколько-нибудь существенный теплообмен с внешней средой.
Теплоемкость при адиабатическом процессе
Выведем уравнение кривой, изображающей адиабатический процесс на рV- диаграмме. Уравнение состояния моля газа имеет вид:
pV = RT. (111)
При бесконечно малом изменении состояния совершаемая работа А = pdV, а изменение внутренней энергии, согласно (83), ΔU -> C V dT. Подставляя эти значения A и ΔU в уравнение первого начала термодинамики (109), получим:
C V dT + pdV = 0. (112)
Это есть уравнение адиабаты в дифференциальной форме. Поскольку оно содержит все три параметра — р, V и Т, — то для исключения одного из них воспользуемся уравнением состояния (111), предварительно продифференцировав его:
pdV + Vdp = RdT. (113)
Умножая уравнение (112) на R, а (113) — на С V искладывая их, получим
(C V + R)pdV + C V Vdp = 0. (114)
Принимая во внимание, что для идеального газа C V + R = = С р, разделим уравнение (114) на произведение C V pV и введем обозначение
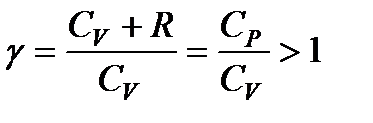 . (115)
. (115)
Тогда (114) примет вид
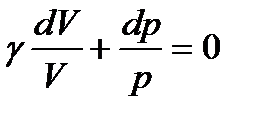 . (116)
. (116)
Учитывая, что постоянный множитель γ можно внести под знак дифференциала, преобразуем (116) к виду
d[γlnV + lnp] = 0 . (117)
Отсюда следует, что величина, стоящая в скобках, должна быть постоянной. Обозначим эту константу как ln(const) . Тогда
γlnV + lnp = ln(const) . (118)
Учитывая, что γlnV = lnV γ и потенцируя выражение (118), получим
pV γ = const. (119)
Это и есть уравнение адиабаты. Его также называют уравнением Пуассона.
Поскольку γ > 1. то кривая, изображаемая этим уравнением (рис. 39), идет круче изотермы pV = const , которая для сравнения показана на том же чертеже штрих-пунктиром. Видно, что при адиабатическом расширении из точки I кривая (119) опускается ниже изотермы, т. е. газ охлаждается, а при адиабатическом сжатии кривая (119) поднимается выше изотермы, т. е. газ нагревается. Величина работы адиабатического процесса может быть особенно просто вычислена с помощью уравнения (109):
A = -C V ΔT = -C V (T 2 - T 1) = C V (T 1 - T 2). (120)
Используя формулу (115), выражение (120) можно преобразовать к виду:
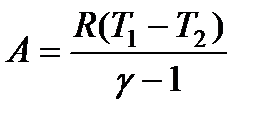 (121)
(121)
Для нахождения же конечной температуры T 2 можно, комбинируя (111) и (119), получить соотношение
TV γ -1 = const . (122)
Для одноатомного газа C v
= 12,5 кДж/(кмоль*К), С P = C v + R
= 20,8 кДж/(кмоль*К), и показатель степени адиабаты равен примерно 1,67. Для двухатомных газов при обычных температурах 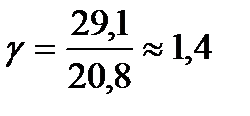 . Для многоатомных газов при возбуждении их колебательных степеней свободы теплоемкости С P
и C v
имеют еще большие значения и показатель степени адиабаты
. Для многоатомных газов при возбуждении их колебательных степеней свободы теплоемкости С P
и C v
имеют еще большие значения и показатель степени адиабаты
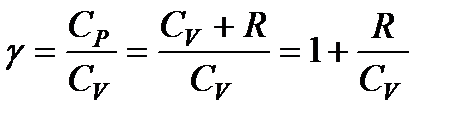 (123)
(123)
еще ближе к единице.
В быстроходных двигателях внутреннего сгорания и при истечении газов через сопла реактивных двигателей процесс расширения газа протекает настолько быстро, что его можно считать практически адиабатическим и рассчитывать по уравнению (119).
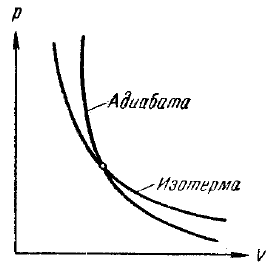
Рис. 39. Адиабата и изотерма
Так как у> 1, то из (122) следует, что при адиабатическом сжатии газ нагревается, а при адиабатическом расширении — охлаждается. Это явление находит применение в дизелях, где воспламенение горючей смеси осуществляется путем адиабатического сжатия. Нагревание газа при адиабатическом сжатии объясняется тем, что во время сжатия над газом производится работа, которая идет на увеличение его внутренней энергии. А так как внутренний энергия идеального газа зависит только от температуры, то это увеличение внутренней энергии проявляется в повышении его температуры. Аналогично объясняется и охлаждение газа при адиабатическом расширении. Охлаждение газа при адиабатическом расширении используется в холодильных машинах.
Мыустановили, как зависит давление газа от температуры, если объем остается неизменным. Теперь посмотрим, как меняется давление некоторой массы газа в зависимости от занимаемого ею объема, если температура остается неизменной. Однако прежде чем перейти к этому вопросу, надо выяснить, как поддерживать температуру газа неизменной. Для этого надо изучить, что происходит с температурой газа, если объем его меняется настолько быстро, что теплообмен газа с окружающими телами практически отсутствует.
Произведем такой опыт. В закрытую с одного конца толстостенную трубку из прозрачного материала (плексигласа или стекла) поместим ватку, слегка смоченную эфиром, и этим создадим внутри трубки смесь паров эфира с воздухом, взрывающуюся при нагревании. Затем быстро вдвинем в трубку плотно входящий поршень (рис. 378). Мы увидим, что внутри трубки произойдет маленький взрыв. Это значит, что при сжатии смеси паров эфира с воздухом температура смеси резко повысилась. Это явление вполне понятно. Сжимая газ внешней силой, мы производим работу, в результате которой внутренняя энергия газа должна увеличиться; это и произошло - газ нагрелся.
Рис. 378. Быстро вдвигая поршень в толстостенную стеклянную трубку, мы заставляем вспыхнуть внутри трубки легко воспламеняющуюся ватку
Теперь предоставим газу возможность расширяться и производить при этом работу против сил внешнего давления. Это можно осуществить, например, так (рис. 379). Пусть в большой бутыли находится сжатый воздух, имеющий комнатную температуру. Дадим воздуху в бутыли возможность расширяться, выходя из небольшого отверстия наружу, и поместим в струе расширяющегося воздуха термометр или колбу с трубкой, изображенную на рис. 384. Термометр покажет температуру более низкую, чем комнатная, а капля в трубке, присоединенной к колбе, побежит в сторону колбы, что также будет указывать на понижение температуры воздуха в струе. Значит, когда газ расширяется и при этом совершает работу, он охлаждается и внутренняя энергия его убывает). Ясно, что нагревание газа при сжатии и охлаждение при расширении являются выражением закона сохранения энергии.

Рис. 379. Термометр 2, помещенный в струе расширяющегося воздуха, показывает более низкую температуру, чем термометр 1
Если мы обратимся к микромиру, то явления нагревания газа при сжатии и охлаждении при расширении станут вполне ясными. Когда молекула ударяется о неподвижную стенку и отскакивает от нее, скорость, а следовательно, и кинетическая энергия молекулы в среднем такие же, как и до удара о стенку. Но если молекула ударяется и отскакивает от надвигающегося на нее поршня, ее скорость и кинетическая энергия больше, чем до удара о поршень (подобно тому как скорость теннисного мяча увеличивается, если его ударить во встречном направлении ракеткой). Надвигающийся поршень передает отражающейся от него молекуле дополнительную энергию. Поэтому внутренняя энергия газа при сжатии возрастает. При отскакивании от удаляющегося поршня скорость молекулы уменьшается, ибо молекула совершает работу, толкая отходящий поршень. Поэтому расширение газа, связанное с отодвиганием поршня или слоев окружающего газа, сопровождается совершением работы и приводит к уменьшению внутренней энергии газа.
Итак, сжатие газа внешней силой вызывает его нагревание, а расширение газа сопровождается его охлаждением. Это явление в некоторой мере имеет место всегда, но особенно резко заметно тогда, когда обмен теплотой с окружающими телами сведен к минимуму, ибо такой обмен может в большей или меньшей степени компенсировать изменение температуры. Процессы, при которых теплообмен с внешней средой отсутствует, называют адиабатическими.
Возвратимся к вопросу, поставленному в начале параграфа. Как обеспечить постоянство температуры газа, несмотря на изменение его объема? Очевидно, для этого надо непрерывно передавать газу теплоту извне, если он расширяется, и непрерывно отбирать от него теплоту, передавая ее окружающим телам, если газ сжимается. В частности, температура газа остается практически постоянной, если расширение или сжатие газа производится очень медленно, а теплообмен с внешней средой происходит достаточно быстро. При медленном расширении теплота от окружающих тел передается газу и его температура снижается так мало, что этим снижением можно пренебречь. При медленном сжатии теплота, наоборот, передается от газа к окружающим телам, и вследствие этого температура его повышается лишь ничтожно мало. Процессы, при которых температура поддерживается неизменной, называют изотермическими.
225.1. Почему при накачивании воздуха в велосипедную шину насос заметно нагревается?
В производственных процессах, связанных с использованием газов (диспергирование, перемешивание, пневмотранспорт, сушка, абсорбция и т. д.), перемещение и сжатие последних происходит за счет энергии, сообщаемой им машинами, которые носят общее название компрессионных . При этом производительность компрессионных установок может достигать десятков тысяч кубометров в час, а давление изменяется в пределах 10 –8 –10 3 атм., что обусловливаетбольшое разнообразие типов и конструкций машин, применяемых для перемещения, сжатия и разрежения газов. Машины, предназначенные для создания повышенныхдавлений, получили название компрессоров, а машины, работающие на создание разрежения –вакуум-насосов .
Классифицируют компрессионные машины в основном по двум признакам: принципу действия и степени сжатия. Степень сжатия – это отношение конечного давления газа на выходе из машиныр 2 к начальному давлению на входеp 1 (т. е.p 2 /p 1).
По принципу действия компрессионные машины подразделяют на поршневые, лопастные (центробежные и осевые), ротационные и струйные.
По степени сжатия различают:
– компрессоры, используемые для создания высоких давлений, со степенью сжатия р 2 /р 1 > 3;
– газодувки, служащие для перемещения газов при большом сопротивлении газопроводной сети, при этом 3 > p 2 /p 1 >1,15;
– вентиляторы, применяемые для перемещения больших количеств газа при p 2 /p 1 < 1,15;
– вакуум-насосы, отсасывающие газ из пространства с пониженным давлением (ниже атмосферного) и нагнетающие его в пространство с повышенным (выше атмосферного) или атмосферным давлением.
В качестве вакуум-насосов могут быть использованы любые компрессионные машины; более глубокий вакуум создают поршневые и ротационные машины.
В отличие от капельных жидкостей, физические свойства газов функционально зависят от температуры и давления; процессы перемещения и сжатия газов связаны с внутренними термодинамическими процессами. При малых перепадах давлений и температур изменения физических свойств газов в процессе их движения с малыми скоростями и давлениями, близкими к атмосферному, незначительны. Это дает возможность использования всех основных положений и законов гидравлики для их описания. Однако при отклонении от нормальных условий, в особенности при высоких степенях сжатия газа, многие положения гидравлики претерпевают изменение.
Термодинамические основы процесса сжатия газов
Влияние температуры на изменение объема газа при постоянном давлении, как известно, определяется законом Гей – Люссака, т. е. при p = const объем газа прямо пропорционален его температуре:
где V 1 иV 2 – объемы газа соответственно при температурахТ 1 иТ 2 , выраженные по шкале Кельвина.
Связь между объемами газа при разных температурах может быть представлена зависимостью
 , (4.1)
, (4.1)
где V иV 0 – конечный и начальный объемы газа, м 3 ;t иt 0 – конечная и начальная температура газа, °С;β t – относительный коэффициент объемного расширения, град. –1 .
Изменение давления газа в зависимости от температуры:
 , (4.2)
, (4.2)
где р ир 0 – конечное и начальное давление газа, Па;β р – относительный температурный коэффициент давления, град. –1 .
Масса газа М
при
изменении его объема остается постоянной.
Если ρ 1 иρ 2 плотности двух температурных состояний
газа, то и
и либо
либо ,
т.е. плотность газа при постоянном
давлении обратно пропорциональна его
абсолютной температуре.
,
т.е. плотность газа при постоянном
давлении обратно пропорциональна его
абсолютной температуре.
По закону Бойля-Мариотта, при одной и
той же температуре произведение удельного
объема газа v
на значение его давленияр
есть величина постояннаяp
v
= const.
Следовательно, при постоянной температуре ,
а
,
а ,
т. е. плотность газа прямо пропорциональна
давлению, так как
,
т. е. плотность газа прямо пропорциональна
давлению, так как .
.
Учитывая уравнение Гей-Люссака, можно получить соотношение, связывающее три параметра газа: давление, удельный объем и его абсолютную температуру:
 . (4.3)
. (4.3)
Последнее уравнение носит название уравнения Клайперона . В общем виде:
 либо
либо , (4.4)
, (4.4)
где R – газовая постоянная, которая представляет собой работу, совершаемую единицей массы идеального газа в изобарном (p = const) процессе; при изменении температуры на 1° газовая постояннаяR имеет размерность Дж/(кгград):
 , (4.5)
, (4.5)
где l р – удельная работа изменения объема, совершаемого 1 кг идеального газа при постоянном давлении, Дж/кг.
Таким образом, уравнение (4.4) характеризует состояние идеального газа. При давлении газа свыше 10 атм использование этого выражения вносит погрешность в расчеты (p v ≠RT ), поэтому рекомендуется пользоваться формулами, которые более точно описывают зависимость между давлением, объемом и температурой реального газа. Например, уравнением Ван-дер-Ваальса:
 , (4.6)
, (4.6)
где R = 8314/M – газовая постоянная, Дж/(кг·К);М – молекулярная масса газа, кг/кмоль;а ив – величины, постоянные для данного газа.
Величины а ив могут быть рассчитаны по критическим параметрам газа (Т кр ир кр):
 ;
; . (4.7)
. (4.7)
При высоких давлениях величина а/v 2 (дополнительного давления в уравнении Ван-дер-Ваальса) мала по сравнению с давлениемp и ею можно пренебречь, тогда уравнение (4.6) превращается в уравнение состояния реального газа Дюпре:
 , (4.8)
, (4.8)
где величина в зависит только от рода газа и не зависит от температуры и давления.
На практике для определения параметров газа при различных его состояниях чаще пользуются термодинамическими диаграммами: Т –S (температура–энтропия),p–i (зависимость давления от энтальпии),p –V (зависимость давления от объема).

Рисунок 4.1 – Т–S диаграмма
На диаграммеТ –S (рис. 4.1) линияАKВ представляет собой пограничную кривую, которая делит диаграмму на отдельные области, соответствующие определенным фазовым состояниям вещества. Область, расположенная слева от пограничной кривой, представляет собой жидкую фазу, справа – область сухого пара (газа). В области, ограниченной кривойАВK и осью абсцисс, одновременно сосуществуют две фазы – жидкость и пар. ЛинияАK соответствует полной конденсации пара, здесь степень сухостиx = 0. ЛинияKВ соответствует полному испарению,x = 1. Максимум кривой соответствует критической точкеK , в которой возможны все три состояния вещества. Помимо пограничной кривой на диаграмму нанесены линии постоянных температур (изотермы,Т = const) и энтропии (S = const), направленные параллельно осям координат, изобары (p = const), линии постоянных энтальпий (i = const). Изобары в области влажного пара направлены так же, как и изотермы; в области перегретого пара они меняют направление круто вверх. В области жидкой фазы изобары почти сливаются с пограничной кривой, так как жидкости практически несжимаемы.Все параметры газа на диаграмме Т–S отнесены к 1 кг газа.
Так как в соответствии с термодинамическим
определением
 ,
то теплота изменения состояния газа
,
то теплота изменения состояния газа .
Следовательно, площадь под кривой,
описывающей изменение состояния газа,
численно равна энергии (теплоте) изменения
состояния.
.
Следовательно, площадь под кривой,
описывающей изменение состояния газа,
численно равна энергии (теплоте) изменения
состояния.
Процесс изменения параметров газа называют процессом изменения его состояния. Каждое состояние газа характеризуется параметрами p ,v иТ . В процессе изменения состояния газа могут меняться все параметры или один из них оставаться постоянным. Так, протекающий при постоянном объеме процесс называетсяизохорическим , при постоянном давлении –изобарическим , а при постоянной температуре –изотермическим . Когда при отсутствии теплообмена между газом и внешней средой (теплота не отводится и не подводится) изменяются все три параметра газа (p, v ,Т ) в процессе его расширения либо сжатия, процесс называется адиабатическим , а когда изменение параметров газа происходит при непрерывном подводе или отводе теплоты– политропическим .
При изменяющихся давлении и объеме, в зависимости от характера теплообмена с окружающей средой, изменение состояния газа в компрессионных машинах может происходить изотермически, адиабатически и политропически.
При изотермическом процессе изменение состояния газа следует закону Бойля–Мариотта:
pv = const.
На диаграмме p–v
этот процесс
изображается гиперболой (рис. 4.2).
Работа 1 кг газаl
графически
представляется заштрихованной площадью,
которая равна ,
т. е.
,
т. е.
 либо
либо . (4.9)
. (4.9)
Количество тепла, которое выделяется при изотермическом сжатии 1 кг газа и которое необходимо отводить путем охлаждения, чтобы температура газа оставалась постоянной:
 , (4.10)
, (4.10)
где c v иc р – удельные теплоемкости газа при постоянном объеме и давлении, соответственно.
На диаграмме Т–S процесс изотермического сжатия газа от давленияр 1 до давленияр 2 изображается прямой линиейаб , проведенной между изобарамир 1 ир 2 (рис. 4.3).
|
|
|
|
Рисунок
4.2 – Процесс изотермического сжатия
газа на диаграмме
|
Рисунок 4.3 – Процесс изотермического сжатия газа на диаграмме Т–S |
Тепло, эквивалентное работе сжатия, изображается площадью, ограниченной крайними ординатами и прямой аб , т. е.
 .
(4.11)
.
(4.11)

Рисунок
4.4 – Процессы
сжатия газа на диаграмме
 :
:
А – адиабатический процесс;
Б – изотермический процесс
Поскольку в выражение для определения работы, затрачиваемой в изотермическом процессе сжатия, входят только объем и давление, то в пределах приложимости уравнения (4.4) безразлично, какой газ будет сжиматься. Иначе говоря, на изотермическое сжатие 1 м 3 любого газа при одних и тех же начальных и конечных давлениях расходуется одно и то же количество механической энергии.При адиабатическом процессе сжатия газа изменение его состояния происходит за счет изменения его внутренней энергии, а следовательно, и температуры.
В общей форме уравнение адиабатического процесса описывается выражением:
 ,
(4.12)
,
(4.12)
где
 –
показатель адиабаты.
–
показатель адиабаты.
Графически (рис. 4.4) этот процесс на диаграмме p–v изобразится гиперболой более крутой, чем на рис. 4.2., так какk > 1.
Если принять
 ,
то
,
то .
(4.13)
.
(4.13)
Поскольку
 иR
= const, полученное уравнение можно
выразить иначе:
иR
= const, полученное уравнение можно
выразить иначе:
 или
или .
(4.14)
.
(4.14)
Путем соответствующих преобразований можно получить зависимости для других параметров газа:
 ;
; . (4.15)
. (4.15)
Таким образом, температура газа в конце его адиабатического сжатия
 . (4.16)
. (4.16)
Работа, совершаемая 1 кг газа в условиях адиабатического процесса:
 . (4.17)
. (4.17)
Тепло, выделяющееся при адиабатическом сжатии газа, эквивалентно затрачиваемой работе:
С учетом соотношений (4.15) работа на сжатие газа при адиабатическом процессе
 . (4.19)
. (4.19)
Процесс адиабатического сжатия характеризуется полным отсутствием теплообмена между газом и окружающей средой, т.е. dQ = 0, аdS = dQ/T , поэтомуdS = 0.
Таким образом, процесс адиабатического сжатия газа протекает при постоянной энтропии (S = const). На диаграммеТ–S этот процесс изобразится прямой линиейАВ (рис. 4.5).

Рисунок 4.5 – Изображение процессов сжатия газа на диаграмме Т–S
Если в процессе сжатия выделяющееся тепло отнимается в меньшем количестве, чем это необходимо для изотермического процесса (что происходит во всех реальных процессах сжатия), то фактически затрачиваемая работа будет большей, чем при изотермическом сжатии, и меньшей, чем при адиабатическом:
 , (4.20)
, (4.20)
где m
– показатель политропы,k
>m
>1
(для воздухаm ).
).
Значение показателя политропы m зависит от природы газа и условий теплообмена с окружающей средой. В компрессионных машинах без охлаждения показатель политропы может быть больше показателя адиабаты (m >k ), т. е. процесс в этом случае протекает по сверхадиабате.
Работу, затрачиваемую на разрежение газов, рассчитывают по тем же уравнениям, что и работу на сжатие газов. Отличие лишь в том, что р 1 будет меньше атмосферного давления.
Процесс политропического сжатия газа от давленияр 1 до давления р 2 на рис. 4.5 изобразится прямойАС . Количество тепла, выделяемое при политропическом сжатии 1 кг газа, численно равно удельной работе сжатия:
Конечная температура сжатия газа
 . (4.22)
. (4.22)
Мощность, затрачиваемая компрессионными машинами на сжатие и разрежение газов, зависит от их производительности, конструктивных особенностей, теплообмена с окружающей средой.
Теоретическая мощность, затрачиваемая
на сжатие газа
 ,
определяется производительностью и
удельной работой сжатия:
,
определяется производительностью и
удельной работой сжатия:
 , (4.23)
, (4.23)
где G
иV
– массовая и объемная
производительность машины соответственно; –
плотность газа.
–
плотность газа.
Следовательно, для различных процессов сжатия теоретически затрачиваемая мощность:
 ;
(4.24)
;
(4.24)
 ; (4.25)
; (4.25)
 , (4.26)
, (4.26)
где
 –
объемная производительность компрессионной
машины, приведенная к условиям всасывания.
–
объемная производительность компрессионной
машины, приведенная к условиям всасывания.
Фактически затрачиваемая мощность в силу ряда причин больше, т.е. потребляемая машиной энергия выше, чем та, которую она передает газу.
Для оценки эффективности компрессионных машин используют сравнение данной машины с наиболее экономичной машиной того же класса.
Машины с охлаждением сравнивают с машинами, которые сжимали бы газ при данных условиях изотермически. В этом случае к. п. д. носит название изотермического, из:
 , (4.27)
, (4.27)
где N – фактически затрачиваемая мощность данной машиной.
Если машины работают без охлаждения, то сжатие газа в них происходит по политропе, показатель которой выше показателя адиабаты (m k ). Поэтому затрачиваемую мощность в таких машинах сравнивают с мощностью, которую затрачивала бы машина при адиабатическом сжатии газа. Отношение этих мощностей представляет собой адиабатический к.п.д.:
 .
(4.28)
.
(4.28)
С учетом мощности, теряемой на механическое трение в машине и учитываемой механическим к.п.д. – мех, мощность на валу компрессионной машины:
![]() либо
либо . (4.29)
. (4.29)
Мощность двигателя рассчитывается с учетом к.п.д. самого двигателя и к.п.д. передачи:
 . (4.30)
. (4.30)
Установочная мощность двигателя
принимается с запасом ( ):
):
 . (4.31)
. (4.31)
Значение ад колеблется в пределах 0,930,97; из в зависимости от степени сжатия имеет значение 0,640,78; механический к. п. д. меняется в пределах 0,850,95.



